(SeaPRwire) – Unternehmen gibt klinische Datenaktualisierung aus laufender Phase-1-Studie mit
ACTengine® IMA203 TCR-T, das PRAME zielt
- Aktualisierte klinische Daten zu ACTengine® IMA203, das PRAME zielt, bei 30 stark vorbehandelten Patienten mit metastasiertem Melanom im RP2D: 55% bestätigte objektive Ansprechrate, einschließlich Tumorschwund bei 87% der Patienten; mediane Dauer des Ansprechens von 13,5 Monaten einschließlich 11/16 andauernder bestätigter Ansprechen; IMA203 behält weiterhin ein günstiges Sicherheitsprofil
- Zulassungsrelevante randomisierte Phase-2/3-Studie für ACTengine® IMA203 bei Melanom 2L+ ist für 2024 geplant, nach weiteren Diskussionen mit der FDA
- Nächste Datenaktualisierung zu IMA203 und IMA203CD8 (GEN2) ist für 2H 2024 geplant
- Erste klinische Datenaktualisierungen für Immatics’ nächste Generation halbwertszeitverlängerter TCR-Bispezifika, TCER® IMA401 (MAGEA4/8) und TCER® IMA402 (PRAME), aus laufenden Phase-1-Dosis-Eskalationsstudien sind für 2H 2024 geplant; Aktualisierungen sollen Details zur Sicherheit, Pharmakokinetik und ersten Tumoraktivität enthalten
- $201,5 Millionen öffentliches Angebot am 22. Januar 2024 abgeschlossen
- Zum 31. März 2024 verfügte das Unternehmen über flüssige Mittel und Finanzanlagen in Höhe von 609,7 Millionen US-Dollar1 (564,0 Millionen Euro), die die Unternehmensfinanzierung bis 2027 sichern
Houston, Texas und Tübingen, Deutschland, 14. Mai 2024 – (NASDAQ: IMTX, „Immatics“), ein klinisches Biopharma-Unternehmen, das sich auf die Entdeckung und Entwicklung von T-Zell-umlenkenden Krebs-Immuntherapien konzentriert, gab heute ein Geschäftsupdate und die Finanzergebnisse für das Quartal bis zum 31. März 2024 bekannt.
„Unser führender Zelltherapiekandidat IMA203 zeigt weiterhin tiefe und anhaltende Ansprechraten in einem deutlich erweiterten Datensatz seit unserer letzten Auswertung im November 2023. Diese Aktualisierung unterstreicht den bedeutenden Einfluss, den unsere neuartige Immuntherapie auf das Leben von Patienten mit metastasiertem kutanem, uvealem und mukosalem Melanom haben kann und den medizinischen Bedarf, den IMA203 adressieren kann”, sagte Harpreet Singh, Ph.D., CEO und Mitgründer von Immatics. „Zusätzlich zum Fortschritt von IMA203 freuen wir uns auch, in der zweiten Jahreshälfte erste klinische Daten zu den beiden führenden Kandidaten aus unserer Bispezifika-Pipeline vorzustellen.“
Fortschritte des ersten Quartals 2024 und darüber hinaus
ACTengine® IMA203-Monotherapie
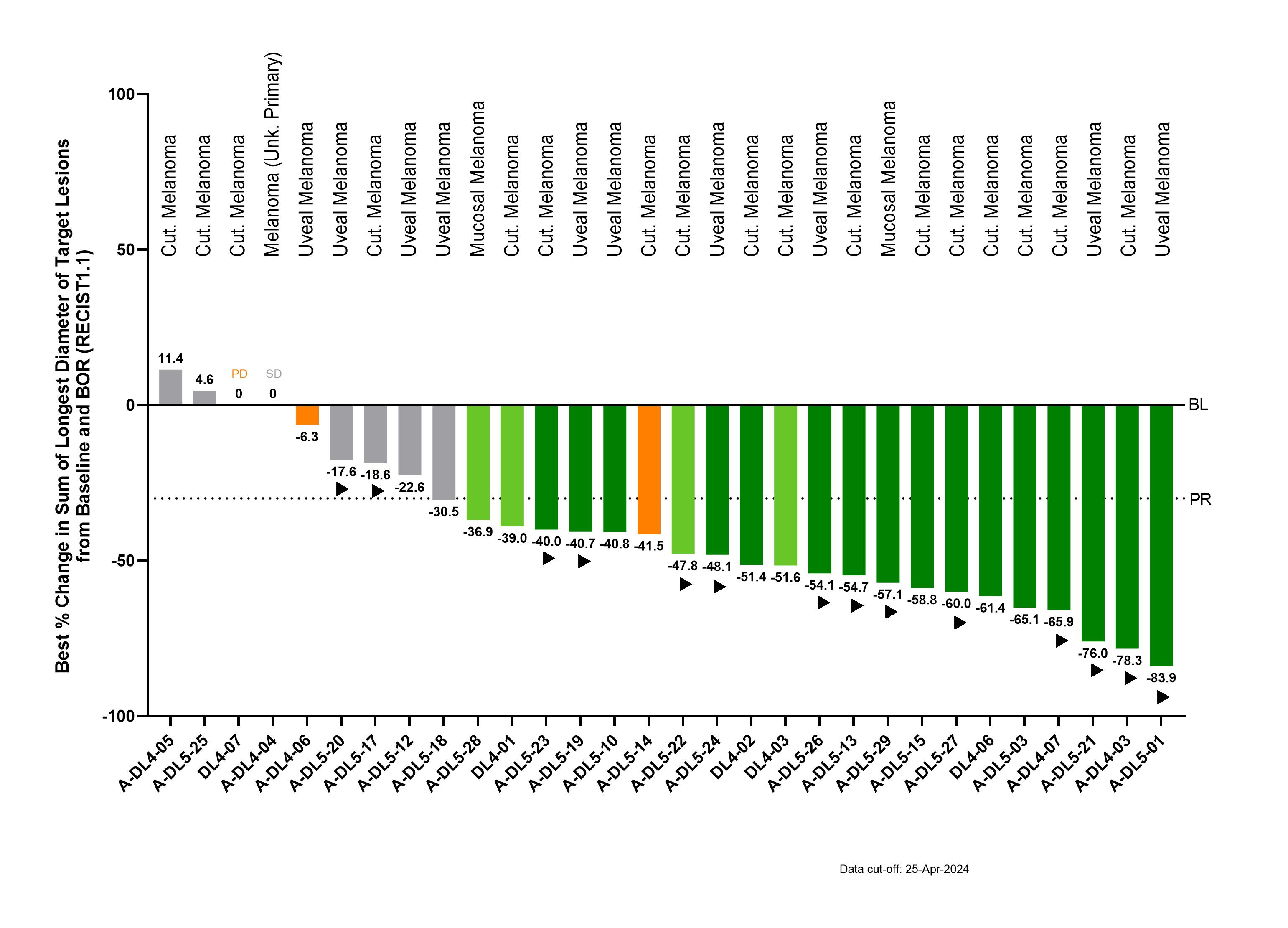
Heute gibt Immatics ein Daten-Update zur IMA203-Monotherapie, die PRAME zielt, aus der laufenden Phase-1-Studie bei der empfohlenen Phase-2-Dosis (RP2D, 1 bis 10 Milliarden Gesamt-TCR-T-Zellen) bei 30 stark vorbehandelten Patienten mit metastasiertem Melanom vor, die für die Wirksamkeit auswertbar sind. Die behandelte Patientenpopulation besteht aus Patienten mit einem Median von 3 vorherigen systemischen Behandlungslinien und setzt sich zusammen aus Patienten mit kutanem Melanom (N=17), Patienten mit uvealem Melanom (N=10), Patienten mit mukosalem Melanom (N=2) und einem Patienten mit Melanom unbekannten Primärtums (N=1). Die aktuellen Daten stellen eine Aktualisierung der zuvor mitgeteilten Zwischenauswertung in der IMA203-Wirksamkeitspopulation beim Melanom dar.
Zum Stichtag 25. April 2024 hat die Behandlung mit IMA203-Monotherapie in der Wirksamkeitspopulation gezeigt:
- Bestätigte objektive Ansprechrate (cORR) von 55% (16/29)
- Krankheitskontrollrate von 90% (27/30)
- Tumorschwund bei 87% (26/30) der Patienten
- Medianer Dauer des Ansprechens (mDOR) betrug 13,5 Monate (min 1,2+, max 21,5+ Monate) einschließlich 11 der 16 bestätigten objektiven Ansprechraten, die zum Stichtag andauerten, und längste Dauer des Ansprechens von >21 Monaten nach Infusion
- Bestätigte Ansprechraten sind in allen Melanom-Subtypen ähnlich (56% (9/16) bei kutanem Melanom; 54% (7/13) bei anderen Melanom-Subtypen)
Bis heute hat IMA203 ein günstiges Sicherheitsprofil beibehalten, ohne behandlungsbedingte Grade-5-Ereignisse in der Sicherheitspopulation (N=65 Patienten über alle Dosierungsstufen und alle Tumorarten hinweg).
Bestes Gesamtansprechen für IMA203 bei RP2D beim Melanom
Weitere Informationen und Details zur IMA203-klinischen Datenaktualisierung beim Melanom finden Sie in der Immatics-Unternehmenspräsentation:
Die nächste Datenaktualisierung mit translationellen und klinischen Daten für IMA203 ist für 2H 2024 auf einem medizinischen Kongress geplant.
Die spätklinische Zelltherapie-Entwicklung von Immatics wird durch ihre differenzierte Herstellung in Bezug auf Zeitrahmen, Fähigkeiten und Einrichtungen unterstützt. ACTengine® IMA203 Zelltherapieprodukte werden innerhalb von 7 Tagen hergestellt, gefolgt von einem 7-tägigen Freigabetest der Qualitätskontrolle mit einer Erfolgsrate von >95%, um die Zieldosis zu erreichen. Das Unternehmen hat außerdem kürzlich den Bau einer ~100.000 Quadratfuß großen F&E- und GMP-Herstellungsanlage mit modularem Design für eine effiziente und kostengünstige Skalierbarkeit abgeschlossen, die frühe klinische Studien und Phase-2/3-Studien sowie die erste kommerzielle Versorgung bedienen soll. Der neue Standort wird Anfang 2025 mit der GMP-Herstellung von Zelltherapieprodukten beginnen. In der Zwischenzeit wird die bestehende GMP-Anlage, die in Zusammenarbeit mit UT Health betrieben wird, bis Ende 2025 in Betrieb bleiben und die Phase-2/3-Zulassungsstudie zunächst ebenfalls bedienen.
Nach konstruktiven Gesprächen und Interaktionen mit der FDA plant Immatics, eine randomisierte Phase-2/3-Studie im 4. Quartal 2024 für IMA203 bei Patienten mit Melanom in zweiter Linie oder später (2L+) einzuleiten, möglicherweise auch Patienten mit uvealem Melanom einschließen.
Es wird erwartet, dass die Phase-2/3-Studie IMA203, das PRAME zielt, bei HLA-A*02:01-positiven Patienten mit kutanem Melanom im Vergleich zu einem Kontrollarm bewertet. Dieser Ansatz entspricht dem „One-Trial“-Ansatz2 der FDA, d.h. eine einzige randomisierte kontrollierte Studie zur Unterstützung der beschleunigten Zulassung und zur Verifizierung des klinischen Nutzens zur Erreichung der vollständigen Zulassung. Die hohe Prävalenz von PRAME (≥95%) bei kutanem Melanom könnte es dem Unternehmen ermöglichen, Patienten ohne PRAME-Vortestung in die Studie aufzunehmen. Dies würde den Studienablauf verbessern und den Bedarf an einer Begleitdiagnostik für den PRAME-Test in dieser Indikation beseitigen. Das endgültige Studiendesign wird derzeit entwickelt und unterliegt weiteren Abstimmungen mit der FDA im Rahmen der laufenden Gespräche. Weitere Details zum endgültigen klinischen Studiendesign werden in der zweiten Jahreshälfte 2024 bekannt gegeben.
IMA203 wird entwickelt, um Patienten mit metastasierendem Melanom zu behandeln, einem häufigen Krebstyp mit steigender Inzidenz sowohl innerhalb als auch außerhalb der Vereinigten Staaten. Derzeit umfasst die für die laufenden Studien in Frage kommende PRAME-positive Melanom-Population, d.h. 2L+, HLA-A*02:01-positiv, etwa 3.000 Patienten mit kutanem Melanom und etwa 300 Patienten mit uvealem Melanom3 in den USA.
ACTengine® IMA203CD8 (GEN2)-Monotherapie
Wie in der zuvor berichteten Zwischenauswertung von 2023 berichtet, zeigte der erste Datenstand zum Produktkandidaten der zweiten Generation von Immatics, IMA203CD8 (bestehend aus PRAME-spezifischen funktionellen CD8+- und CD4+-Zellen), 56% (5/9) cORR mit verbesserter Pharmakologie im Vergleich zu IMA203. mDOR wurde nicht erreicht (min 2,0 Monate, max 11,5 Monate) bei einem mFU von 4,8 Monaten. Zum Stichtag 30. September 2023 wies IMA203CD8 (GEN2) ein handhabbares Sicherheitsprofil auf.
Für IMA203CD8 (GEN2) überwand Immatics im Dezember 2023 die Dosierungsstufe 4a (DL4a, bis ca. 1,6×109 TCR-T-Zellen). Immatics plant, die Dosis-Eskalation fortzusetzen, mit dem Ziel, die optimale Dosis für die weitere Entwicklung zu definieren. Darüber hinaus hat Immatics auch begonnen, seine klinische Reichweite über das Melanom hinaus auf eine breitere Patientenpopulation auszuweiten, wobei der Schwerpunkt auf Eierstock- und Gebärmutterhalskrebs liegt.
Ein nächster Datenstand zu IMA203CD8 (GEN2) ist für die zweite Jahreshälfte 2024 geplant.
Der Artikel wird von einem Drittanbieter bereitgestellt. SeaPRwire (https://www.seaprwire.com/) gibt diesbezüglich keine Zusicherungen oder Darstellungen ab.
Branchen: Top-Story, Tagesnachrichten
SeaPRwire liefert Echtzeit-Pressemitteilungsverteilung für Unternehmen und Institutionen und erreicht mehr als 6.500 Medienshops, 86.000 Redakteure und Journalisten sowie 3,5 Millionen professionelle Desktops in 90 Ländern. SeaPRwire unterstützt die Verteilung von Pressemitteilungen in Englisch, Koreanisch, Japanisch, Arabisch, Vereinfachtem Chinesisch, Traditionellem Chinesisch, Vietnamesisch, Thailändisch, Indonesisch, Malaiisch, Deutsch, Russisch, Französisch, Spanisch, Portugiesisch und anderen Sprachen.
Die T-Zell-engagierenden Rezeptoren (TCER®) von Immatics sind Moleküle der nächsten Generation mit halbwertszeitverlängertem TCR-Bispezifikum. Sie sind